药物临床试验运行管理制度和流程
1.立项准备及审批:
(1)登录https://www.trialos.com进入系统,操作如附件进行。
技术支持电话:021-80348009转8410
(2)项目资料(包括签字文件),按纸质资料要求,扫描成PDF并上传系统。
注:①系统审核通过后,请递交纸质版资料1份至机构办公室存档。
②装订要求:使用两孔可加页的文件夹,文件夹厚度需满足未来增加文件的需求
2.协议签署与审核:
2.1 立项审核通过后可开始协议审核流程,可使用试验申办者/CRO协议模板。
2.2 协议签署流程如下;
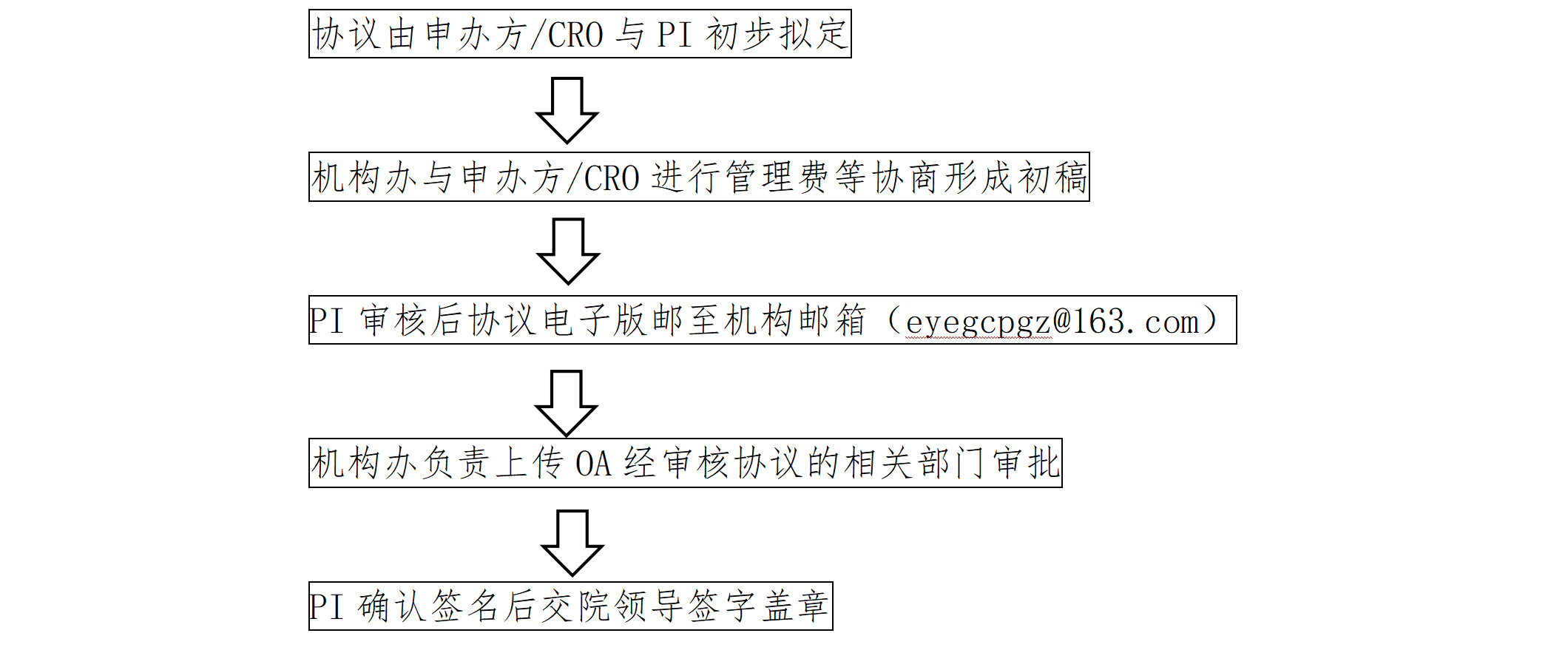
注:研究机构2份,主要研究者1份
2.3 CRC服务须签署《申办方-SMO-机构三方协议》,机构不收取CRC相关管理费。
3.人类遗传资源管理与申报:
具体流程可参考《人类遗传资源管理与申报流程》
注:
①开展临床试验项目:可在人遗办网上公示后开展,批件复印件及备案成功证明递交给机构存档。
②如不属于人类遗传资源国际合作项目:需递交申办方/CRO盖章出具的不需要办理声明及生物样本处理承诺。
4.项目启动工作流程:
项目启动前请完成:
(1)研究协议和CRC协议的签署
(2)人类遗传资源审批/备案的工作完成
(3)申报方要和PI确定启动会时间、地点、参加人员,准备好相关需要签名的表格及文件
项目正式启动。
附件:
附件1: 医疗器械临床试验立项申请表
附件2: 医疗器械立项清单
附件3: 药物临床试验立项申请表
附件4: 药物立项清单
附件5: 研究者简表模板
附件6: 申办方在药试圈立项指引
附件7: 经费说明
附件8: 临床试验中受控文件盖章申请



